Los anticuerpos son una de las principales armas del sistema inmune para reconocer agentes infecciosos y sustancias extrañas al organismo. Son glicoproteínas complejas expresadas en la membrana de los linfocitos B y también secretadas en forma soluble por plasmocitos (estadío final de diferenciación de estos linfocitos) que reconocen moléculas ajenas al organismo a través de regiones de reconocimiento denominadas paratopes. El sistema inmune produce diariamente miles de linfocitos B que expresan anticuerpos diferentes en cuanto a su especificidad de reconocimiento (a qué sustancia extraña o “antígeno” pueden reconocer). Este amplio repertorio de anticuerpos con especificidades distintas es lo que denominamos diversidad.
A mediados de los años 60 del siglo XX se había determinado que los anticuerpos están formados por dos cadenas proteicas de mayor tamaño (pesadas) y dos cadenas livianas. Asimismo, se había establecido un modelo de molécula en forma de Y en la cual los paratopes residen en la punta de los brazos de la Y. Lo que seguía siendo un misterio era cómo un grupo de proteínas casi idénticas en su estructura y composición podían albergar una gran diversidad de reconocimiento antigénico. Para responder esta pregunta era necesario obtener información acerca de la secuencia aminoacídica de varios anticuerpos (particularmente de los paratopes) y establecer comparaciones. Pero esto no era una tarea sencilla, ya que requería obtener cada anticuerpo individual en cantidades suficientes para las técnicas de secuenciación de entonces.
Una de las estrategias para abordar el problema fue el estudio de mielomas, células tumorales derivadas de plasmocitos que producen gran cantidad de anticuerpos. Sin embargo, dado que los mielomas se generan en forma aleatoria no era posible conocer el antígeno reconocido por los anticuerpos que producían, lo cual limitaba la capacidad de comparar las secuencias de anticuerpos específicos para un mismo antígeno.
En 1969, Norman Klinman de la Universidad de Pennsylvania halló la forma de aislar linfocitos B secretores de un único tipo de anticuerpo. La técnica consistía en irradiar a un ratón para eliminar la capacidad de generar anticuerpos propios y luego inyectarle linfocitos de interés, los cuales se alojaban en el bazo. Posteriormente, el bazo era cortado en pequeños fragmentos que se cultivaban in vitro en presencia del antígeno para inducir la producción de anticuerpos. La limitación era que rendía cantidades muy reducidas de anticuerpo y que la producción sólo duraba pocas semanas. (NR Klinman, 'Antibody with Homogeneous Antigen Binding Produced by Splenic Foci in Organ Culture', /Immunochemistry (1969) 6(5): 757-759).
Posteriormente, en 1970, Brigitte Askonas y colaboradores hallaron la forma de clonar linfocitos B productores de anticuerpos de especificidad conocida a partir de bazos de ratones inmunizados. El inconveniente, sin embargo, era que las células sobrevivían un corto tiempo. (BA Askonas, AR Williamson, BE Wright, 'Selection of a Single Antibody-Forming Cell Clone and its Propagation in Syngeneic Mice', /Proceedings of the National Academy of Sciences USA (1970) 67(3):1398-1403).
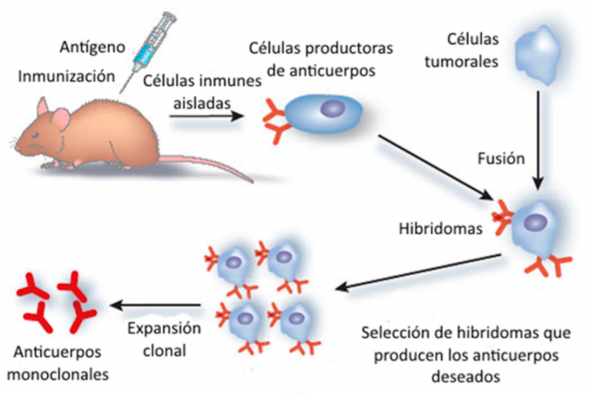
El problema de la obtención de células de larga vida productoras de anticuerpos de especificidad definida fue solucionado definitivamente por César Milstein, un científico argentino, graduado en la Universidad de Buenos Aires, que se hallaba trabajando en el Laboratory of Molecular Biology de la Universidad de Cambridge desde 1966, y su colaborador Georges Köhler, un científico alemán que se unió al laboratorio de Milstein en 1974 luego de obtener su doctorado en el Basel Institute for Immunology de Suiza. Ambos científicos desarrollaron un método que consiste en fusionar células de mieloma con linfocitos B de un ratón inmunizado con el antígeno de interés.

César Milstein recibe el Premio Nobel de Medicina o Fisiología en 1984. (Tomado de Trends in Immunology Vol.23 No.6, Junio 2002).
El objetivo era transferir a los linfocitos específicos el rasgo de inmortalidad de las células de mieloma. Su hipótesis fue que la célula híbrida formada (hibridoma) no sólo produciría anticuerpos de especificidad conocida sino que además sobreviviría en forma indefinida. Para su prueba piloto, Milstein y Köhler utilizaron como antígeno eritrocitos de carnero (dado que contaban con un método sencillo para detectar anticuerpos específicos) y como agente de fusión utilizaron virus Sendai. Para enero de 1975 habían realizado varias pruebas exitosas que demostraban la factibilidad del método. Los hibridomas producían anticuerpos específicos, lo hacían en gran cantidad y la frecuencia de hibridomas específicos era mucho más elevada que lo esperado. (G. Köhler and C. Milstein, 'Continuous Cultures of Fused Cells Secreting Antibody of Predefined Specificity', Nature (1975) 256 (5517): 495-497).
Por este hallazgo, en 1984, Milstein y Köhler fueron laureados con el premio Nobel de Fisiología o Medicina. Notablemente, Milstein siempre enfatizó que su objetivo para desarrollar los anticuerpos monoclonales fue responder una pregunta de ciencia básica (la generación de diversidad de los anticuerpos). Aunque su objetivo no fue comercial, el hecho es que los anticuerpos monoclonales representan un tercio de los medicamentos nuevos aprobados anualmente en el mundo. Se utilizan no solo en el tratamiento de numerosas enfermedades sino también en diagnóstico, investigación biomédica, etc.
Aunque Milstein envió la información del descubrimiento al organismo responsable de patentar invenciones de investigadores del Medical Research Council (al cual pertenecía el laboratorio de Milstein), este organismo decidió no patentarlo porque “no lograban identificar aplicaciones inmediatas”. Las primeras patentes relacionadas a anticuerpos monoclonales fueron otorgadas a Hilary Koprowski y colaboradores en 1979-1980, quienes utilizaron una línea de mieloma que les había cedido Milstein con la condición de que no se empleara en ninguna patente. Pero esa es otra historia…

Pablo C. Baldi es doctor de la Universidad de Buenos Aires, profesor asociado de la cátedra de Inmunología e investigador principal, CONICET, IDEHU (UBA-CONICET)











Dejar un comentario