Energía y vida van de la mano. Cuando respiramos, el oxígeno de nuestra respiración llega a cada una de los trillones de células de nuestro organismo, donde se quema la glucosa en la respiración celular. Somos máquinas fantásticas de producción de energía. El estudio de la producción, la cuantificación y el intercambio de la energía en sistemas biológicos es una rama de la química física denominada bioenergética, y su principal exponente y quien sentó las bases en esta área fue Peter Mitchell (1920-1992) (figura 1).

Fig. 1. Peter Mitchell. Tomado de Nobel Foundation Archive
El paper seminal de Mitchell, publicado en Nature, en 1961 (Mitchell, P. Coupling of phosphorylation to electron and hydrogen transfer by a chemiosmotic type of mechanism. Nature, 191: 144-148, figura 2) introdujo la teoría quimiosmótica iniciando, así, una revolución que traspasó la bioenergética. Sentó las bases del entendimiento del mecanismo fundamental de la conservación de la energía en la célula y se comenzó a reconocer a la mitocondria como el centro energético celular. La obtención del Premio Nobel en 1978 contribuyó a establecer la validez de esta teoría que explica cómo se acopla el transporte de electrones mitocondrial con la producción de ATP, y que en sus inicios no recibió mucho apoyo de investigadores reconocidos del área.

Fig. 2. Mitchell, P. Coupling of phosphorylation to electron and hydrogen transfer by a chemiosmotic type of mechanism. Nature. 1961, 191: 144-148
Mitchell desarrolló sus ideas durante su doctorado en la Universidad de Cambridge en los años cuarenta del siglo pasado, y durante su estancia en Edimburgo entre 1955 y 1962. Es durante su estadía allí que publicó su primer trabajo en la revista Nature en 1961. Le tomó siete años terminar su doctorado. En parte porque tuvo que equilibrar el tiempo entre su interés principal (la bioenergética) y la producción de antibióticos (actividad necesaria en tiempos de guerra) y, en parte también, porque uno de sus evaluadores le pidió que corrigiera la sección discusión ya que le parecía muy superficial como para una tesis de doctorado. Su interés fue siempre el metabolismo vectorial, es decir, todas aquellas reacciones biológicas que tienen una dirección en el tiempo y en el espacio.
Las ideas de Mitchell fueron en un principio ignoradas y hostigadas por la comunidad científica, ya que las explicaba con conceptos que no eran familiares para la mayoría de los enzimólogos de aquella época. Mitchell, que era brillante y eximio argumentador, a veces era grandilocuente e irascible, lo que enfurecía a sus oponentes y exacerbaba la situación de hostigamiento hacia sus ideas. Igualmente, este contexto no fue fácil para Mitchell y dejó su puesto en la Universidad de Edimburgo luego de padecer úlceras estomacales. En el período siguiente de dos años alejado de la ciencia, acondicionó la residencia familiar en Conwall llamada Glynn House adicionándole en la parte posterior un instituto de investigación privado (Glynn Research Ltd.). De esta manera, estaba preparado para volver a defender sus ideas, ¡y vaya si lo logró! En la década siguiente, junto a su colega Jennifer Moyle, logró probar de forma inequívoca su teoría quimiosmótica.
La estructura final de su teoría tomó forma en sus subsiguientes publicaciones: dos en Nature en 1965 y 1967, y dos pequeños tomos (cariñosamente conocidos como “los pequeños libros grises”) publicados por Glynn Research Ltd. Para poder comprender los postulados básicos, recordemos la estructura de la mitocondria que se presenta en la figura 3. En forma muy general, y sin entrar en detalles cuantitativos, la teoría funciona así:
- Moléculas como la glucosa son oxidadas para formar compuestos dadores de protones que son utilizados por la cadena respiratoria que se encuentra en la membrana interna de la mitocondria.
- Estos compuestos donan electrones que se mueven en una dirección específica a través de complejos enzimáticos embebidos en la membrana interna mitocondrial. La energía que se produce se utiliza para bombear protones a través de la membrana interna mitocondrial desde la matriz hacia el espacio intermembrana.
- Como la membrana es impermeable a distintas moléculas e iones, se genera un reservorio y un gradiente de protones (que posee, en consecuencia, un componente eléctrico y otro de concentración). La combinación de este gradiente de pH y de potencial se lo conoce como fuerza protón-motriz.
- Esta fuerza es la que permite la fosforilación de ADP a ATP por la ATP sintasa. A la vez que se produce la fosforilación y la producción de ATP (reconocida como la “moneda de intercambio de energía”), la enzima bombea protones en sentido contrario, desde el espacio intermembrana hacia la matriz.
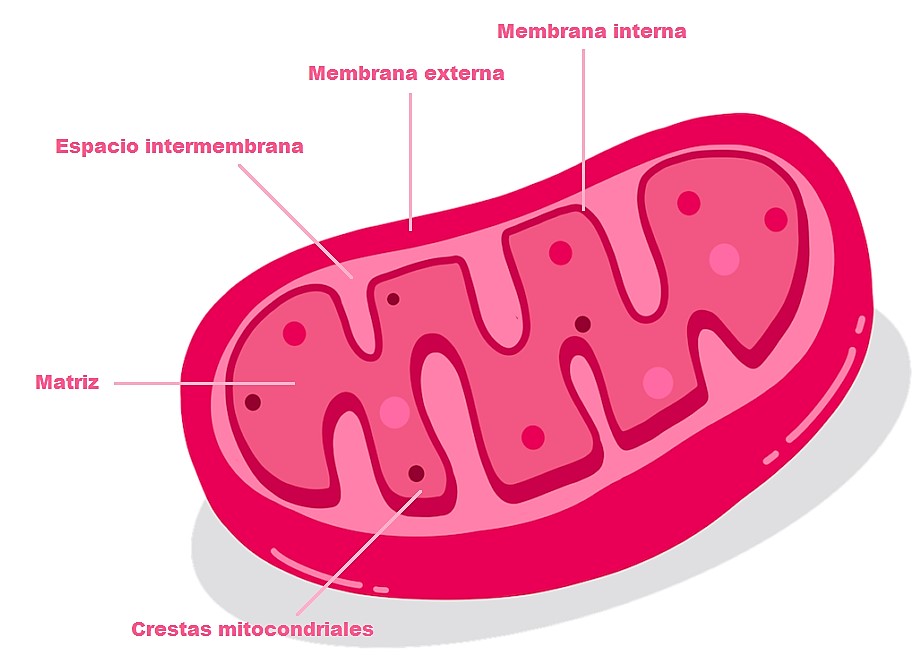
Fig. 3. Estructura mitocondrial
La manera en que la mitocondria genera energía es uno de los mecanismos más fantásticos e interesantes en la biología, en un nivel equiparable a los avances realizados por Watson y Crick con respecto a la estructura del ADN. Este mecanismo es fundamental para la vida. Un rasgo característico de la teoría de Mitchell es que reconcilia distintos modos de producir energía que parecían imposibles de relacionar, como la fotosíntesis y la respiración celular. La gloria máxima de las ideas de Mitchell tuvo lugar cuando John Walker y Paul Boyer recibieron el Premio Nobel en 1997 por describir en detalle y a escala atómica la estructura de la ATP sintasa. Un ejemplo maravilloso de nanotecnología biológica, ya que fue descripta como un rotor molecular. Pero, bueno, esa ya es otra historia.

Silvia Álvarez es doctora de la Universidad de Buenos Aires, profesora adjunta de Fisicoquímica y subsecretaria de Comunicación y Cultura, Facultad de Farmacia y Bioquímica (FFyB-UBA).
Juan Santiago Adan Arean es bioquímico, estudiante de Doctorado de la Universidad de Buenos Aires y docente de la Cátedra de Fisicoquímica en la Facultad de Farmacia y Bioquímica (FFyB-UBA).
Fuentes
Mitchell, P. Coupling of phosphorylation to electron and hydrogen transfer by a chemiosmotic type of mechanism. Nature, 1961 (191): 144-148.
Mitchell, P. & Moyle, J. Evidence discriminating between the chemical and the chemiosmotic mechanisms of electron transport phosphorylation. Nature, 1965 (208): 1205-1206.
Mitchell, P. & Moyle, J. Chemiosmotic hypothesis of oxidative phosphorylation. Nature, 1967 (213): 137-139.
https://www.life.illinois.edu/crofts/bioph354/mitchell.html










Dejar un comentario