Unas 8.600.000 personas mueren por año debido a cardiopatías isquémicas en el mundo, según datos de la Organización Mundial de la Salud (OMS) y, junto con los accidentes cerebrovasculares, constituyen las principales causas de muerte durante los últimos 15 años. Solo en la Argentina anualmente unas 50.000 personas fallecen por tal causa. Pero, más grave aún, se estima que la incidencia continuará incrementándose, en gran parte debido a la creciente exposición a factores de riesgo, y también al aumento de la expectativa de vida a nivel mundial. A pesar de que se avanzó notablemente en su prevención y tratamiento, no existe aún una terapia coadyuvante efectiva que prevenga los daños de los procesos de isquemia-reperfusión característicos en estas patologías. Asimismo, se ha postulado que la función de la proteína quinasa activada por AMP (AMPK) resulta fundamental en esos procesos, aunque sus mecanismos no son del todo bien conocidos. Se exponen aquí hallazgos que brindan información novedosa sobre el papel que desempeña esta proteína en el miocardio sometido a isquemia-reperfusión, que podrían abrir en el futuro un horizonte promisorio en el desarrollo de nuevas estrategias.
Las enfermedades cardiovasculares constituyen una de las principales causas de mortalidad y discapacidad en todo el mundo. No solo la situación actual reviste gran preocupación, sino que también es importante destacar que la OMS predice que esta patología será una causa aún más importante de mortalidad en 2030, debido a la creciente urbanización, al envejecimiento tardío de la población y a los nuevos modos de vida, que promueven el incremento progresivo de los factores de riesgo cardiovascular.
El corazón es un órgano aerobio, ya que para su adecuado funcionamiento depende absolutamente de una entrega normal de oxígeno, el cual es aportado por la sangre oxigenada que le llega a través de las arterias coronarias. La isquemia cardíaca es la falta o bien la disminución del flujo sanguíneo coronario que produce un desequilibrio entre el aporte y la demanda de sangre oxigenada por el corazón, comprometiendo la entrega de oxígeno y nutrientes, como también el lavado de productos del metabolismo celular cuya acumulación es potencialmente tóxica. Si la intensidad y la duración de la isquemia es suficiente para producir la necrosis o muerte de las células cardíacas letalmente lesionadas, ocurre el infarto agudo de miocardio (IAM) conocido también como ataque al corazón, y se produce en cuestión de segundos, el cese de la actividad contráctil y la alteración de las propiedades eléctricas cardíacas que se acompañan de cambios electrocardiográficos.
El alto porcentaje de la población mundial afectado por la cardiopatía isquémica ha impulsado en las dos últimas décadas el desarrollo de estrategias de prevención de riesgos, de tratamientos y técnicas que permiten la reintroducción oportuna del flujo sanguíneo al miocardio isquémico. Las estrategias actuales de tratamiento que aumentan el flujo sanguíneo coronario y el suministro de oxígeno al miocardio (como las técnicas percutáneas y quirúrgicas o el uso de vasodilatadores, antiagregantes plaquetarios, anticoagulantes o terapia trombolítica), esenciales para limitar el tamaño del infarto y preservar la funcionalidad del tejido, junto con las estrategias desarrolladas para disminuir la demanda de oxígeno miocárdico (como el empleo de β-bloqueantes), han mejorado en gran medida el pronóstico general de los pacientes con cardiopatía isquémica.
A pesar de que la restauración del flujo sanguíneo del miocardio isquémico resulta esencial para reducir el tamaño del infarto y limitar la extensión del daño irreversible, el proceso de reperfusión, por sí mismo, puede inducir una nueva lesión que, consecuentemente, reduce los efectos beneficiosos del restablecimiento del flujo sanguíneo y que, incluso, podría generar una lesión mayor a la resultante de la isquemia.
EL CAMINO HACIA NUEVAS TERAPIAS
No existe hoy una terapia coadyuvante efectiva para prevenir los daños por reperfusión. Si bien en los últimos años los mecanismos moleculares responsables de la injuria por isquemia-reperfusión, así como los mecanismos endógenos protectores y el desarrollo de intervenciones experimentales que limitan el grado de evolución del infarto de miocardio han sido exhaustivamente estudiados, los alentadores resultados de laboratorio no se corresponden con los resultados obtenidos a partir de la realización de ensayos clínicos.
En este contexto, resulta indiscutible la necesidad de explorar nuevos enfoques terapéuticos que permitan abordar con mayor eficacia el tratamiento. Con relación a ello, una de las estrategias que ha surgido en los últimos años presenta, como blanco de acción, la optimización del metabolismo energético. Cada vez son más las evidencias experimentales y clínicas que sugieren la importancia de ahondar en el conocimiento de la influencia del metabolismo energético en el daño por isquemia-reperfusión cardíaca debido a su potencial aplicación en el desarrollo de intervenciones terapéuticas que permitan incrementar la eficiencia energética y, por ende, la función cardíaca, durante y después de producirse un evento isquémico.
Por otra parte, la proteína quinasa activada por AMP (AMPK) es una enzima que desempeña una importante función en numerosos tejidos, ya que actúa como un sensor de los niveles energéticos de la célula, y es capaz de coordinar los procesos anabólicos y catabólicos, con el propósito de restablecer la homeostasis celular. A causa del alto requerimiento de síntesis de trifosfato de adenosina (ATP) –la moneda energética celular– que presenta el corazón, la función desempeñada por esta enzima ha adquirido especial relevancia en este órgano.
En este contexto, el trabajo de tesis fue llevado a cabo con el propósito de ahondar en el conocimiento del papel desempeñado por la activación intrínseca de la AMPK en la isquemia y en la reperfusión del miocardio. Dado que, desde el inicio de los síntomas asociados con el infarto agudo de miocardio, los niveles de ácidos grasos ascienden en el plasma, y sabiendo que la disponibilidad de los diferentes sustratos exógenos condiciona el estado metabólico del cardiomiocito, se investigó el papel desempeñado por esta enzima en presencia de glucosa como único sustrato exógeno, y en presencia de glucosa y elevadas concentraciones de ácidos grasos como sustratos metabólicos exógenos.
Para llevar a cabo los objetivos propuestos, se empleó un modelo de isquemia-reperfusión simuladas, utilizando aurículas izquierdas aisladas de ratas. En estas condiciones se determinó el perfil de activación endógeno de la AMPK y los efectos producidos por la inhibición farmacológica de esta enzima.
Los resultados obtenidos en este trabajo de tesis doctoral permitieron demostrar que la AMPK es significativamente activada durante la isquemia, y que su activación permanece durante las primeras etapas de la reperfusión, desempeñando un papel sustancial en la mediación de las respuestas metabólicas y funcionales del miocardio tanto en la isquemia como en la reperfusión. Si bien, los sustratos metabólicos exógenos a los cuales el miocardio es expuesto no ejercerían efectos sobre el perfil de activación de la AMPK, condicionarían el papel desempeñado por dicha enzima.
Al respecto, se pudo demostrar que la activación intrínseca de AMPK ejerce efectos cardioprotectores en el miocardio sometido a isquemia-reperfusión cuando la glucosa es el único sustrato energético disponible. En estas condiciones, entre los principales resultados obtenidos se destaca que la enzima ejercería efectos beneficiosos que incrementarían la recuperación parcial del contenido tisular de ATP y la respuesta contráctil, a través de la regulación de procesos metabólicos celulares. A su vez, la activación parcial del proceso de autofagia por esta enzima, desempeñaría acciones beneficiosas sobre el miocardio reperfundido al promover la remoción de mitocondrias alteradas y disfuncionales. Este hecho resultaría significativamente relevante, ya que en este trabajo se pudo comprobar que la inhibición de la autofagia en el miocardio sometido a isquemia reperfusión conduce a un mayor deterioro de la estructura y de la función mitocondrial durante la reperfusión, que se acompaña de una menor producción energética y de la aparición de taquiarritmias –arritmias por aumento de la actividad eléctrica– espontáneas severas de origen mitocondrial.
Contrariamente, la activación intrínseca de la AMPK cuando las aurículas fueron incubadas en presencia de altas concentraciones de ácidos grasos, como ocurre en los pacientes que sufren infarto agudo de miocardio, ejerció efectos deletéreos. En estas condiciones, la AMPK promovería la oxidación de los ácidos grasos durante la reperfusión, hecho que generaría el desacople entre la glucólisis y la fosforilación oxidativa, contribuyendo a la disminución en la recuperación del contenido tisular de ATP, hecho que sería responsable, al menos en parte, de la menor recuperación de la función contráctil. Finalmente, la activación del proceso de autofagia, aunque significativamente menor, resultaría suficiente, al menos en parte, para promover la remoción de las mitocondrias disfuncionales y prevenir el desarrollo de taquiarritmias espontáneas.
A partir de los resultados obtenidos en este trabajo, se puede concluir que la disponibilidad de los diferentes sustratos metabólicos exógenos a los cuales los cardiomiocitos sometidos a isquemia-reperfusión son expuestos, resultaría un factor determinante de la condición metabólica celular que, a su vez, influiría en el papel desempeñado por la AMPK. El balance de los efectos producidos por la AMPK sobre el metabolismo de la glucosa y de los ácidos grasos, determinarían la magnitud de los daños producidos por la isquemia y la reperfusión del miocardio, condicionando la recuperación funcional post-isquémica.
En este contexto, se enfatiza la importancia de ahondar en la investigación acerca de la influencia del metabolismo energético celular en la injuria por isquemia-reperfusión cardíaca, así como en la exploración de intervenciones que, a través de su regulación, pudieran ser empleadas en las primeras horas críticas desde la instauración de los síntomas de infarto agudo de miocardio.
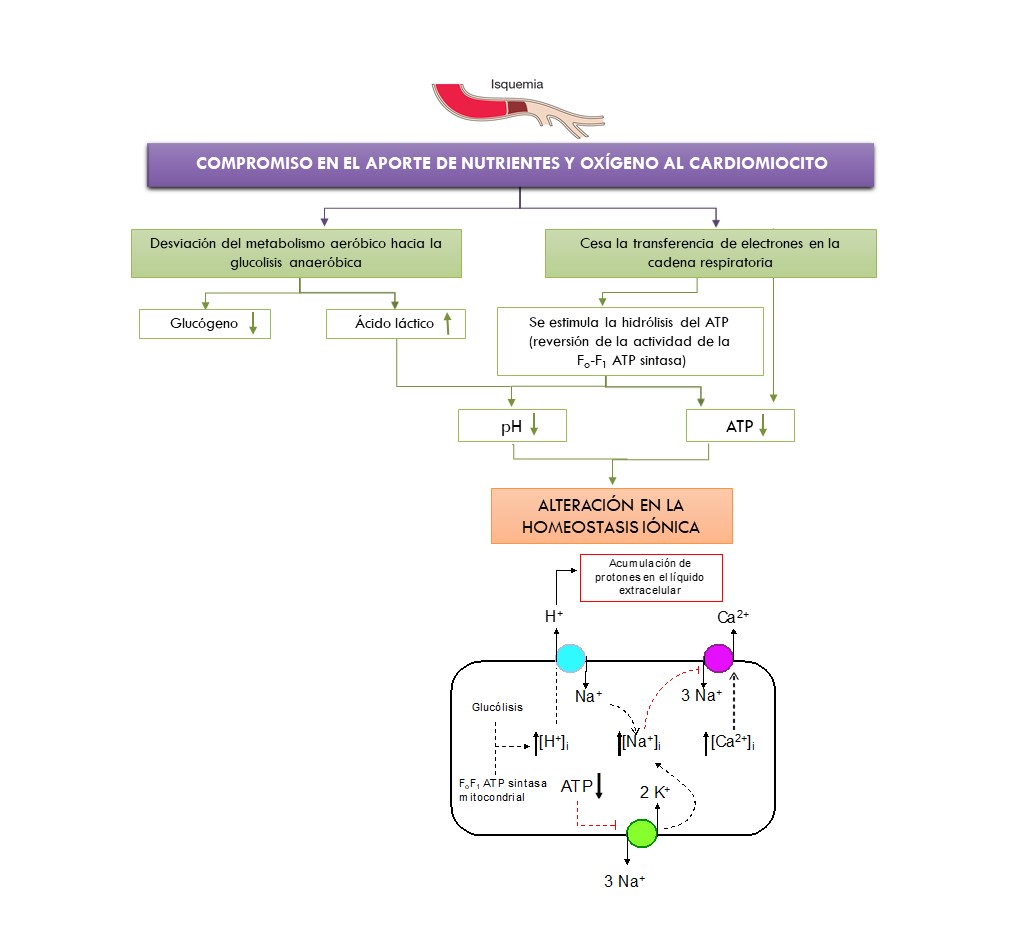
En la isquemia la amenaza inmediata está representada por la disminución o ausencia de la entrega de oxígeno al miocito, que genera una desviación desde el metabolismo aeróbico hacia la glucólisis anaeróbica en cuestión de segundos. Esta situación se acompaña de profundas consecuencias funcionales, bioquímicas y morfológicas, que llevan al rápido deterioro de la actividad contráctil y a la alteración de las propiedades elásticas y eléctricas de las células cardíacas. Entre estos fenómenos se destacan la disminución o supresión de la función contráctil, el aumento de la tensión de reposo, la edematización citosólica y la activación de proteasas y fosfolipasas.
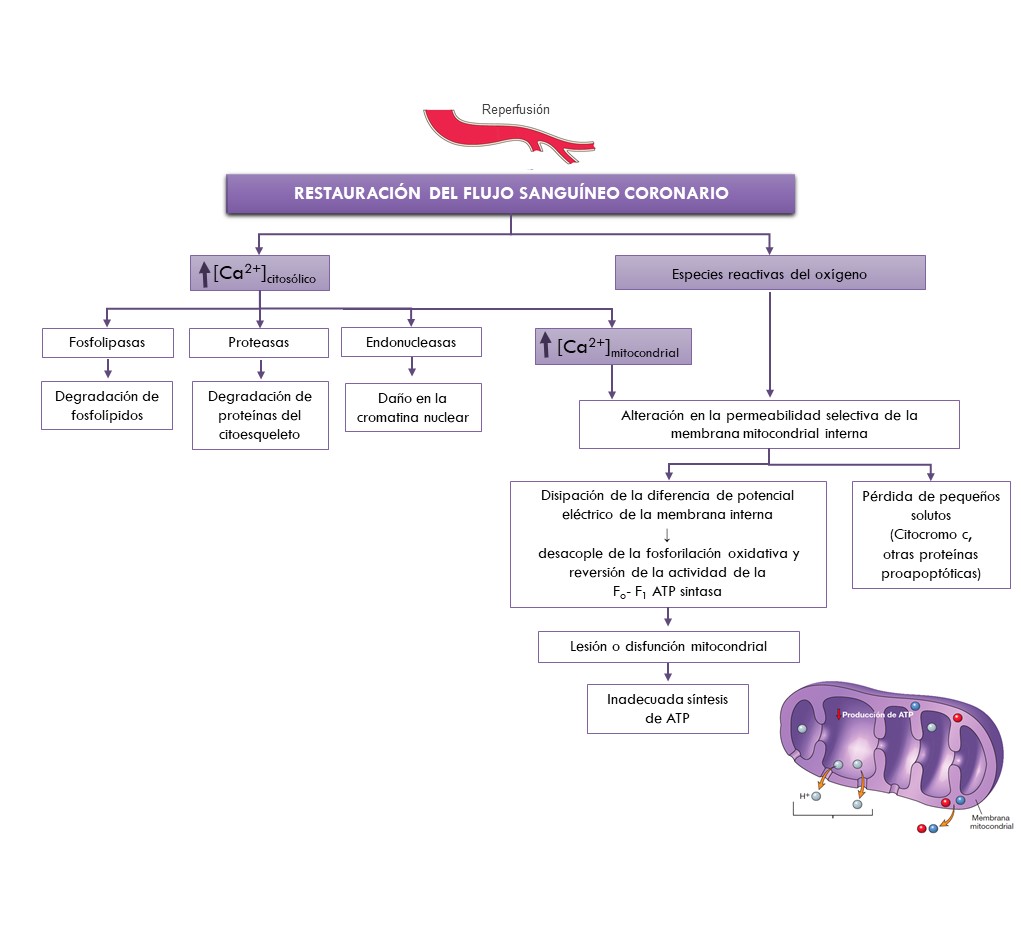
Las alteraciones en la homeostasis iónica producida durante la isquemia se exacerban en los primeros minutos de la reperfusión. Los niveles elevados de calcio intracelular activan numerosas enzimas, con efectos celulares potencialmente perjudiciales. A su vez, los elevados niveles de calcio junto con el estallido en la producción de radicales libres del oxígeno, producido por la reactivación de la cadena respiratoria, conducen a la pérdida de la permeabilidad selectiva de la membrana interna mitocondrial, representando una de las principales causas de la injuria por reperfusión.
Glosario
Isquemia: La falta o bien la disminución del flujo sanguíneo coronario que produce un desequilibrio entre el aporte y la demanda de sangre oxigenada por el corazón, comprometiendo la entrega de oxígeno y nutrientes, como también el lavado de productos del metabolismo celular cuya acumulación es potencialmente tóxica.
Reperfusión: restauración del flujo sanguíneo al tejido isquémico.
Infarto agudo de miocardio (IAM): muerte del músculo cardíaco por necrosis debida a isquemia.
Proteína quinasa activada por AMP (AMPK): serina-treonina quinasa que desempeña una importante función en numerosos tejidos, actúa como un sensor de los niveles energéticos de la célula, siendo capaz de coordinar los procesos anabólicos y catabólicos, con el propósito de restablecer la homeostasis celular.
Bibliografía ampliatoria
Los resultados que constituyen este trabajo de tesis han sido parcialmente difundidos y publicados en:
Hermann R, Mestre Cordero VE, Fernández Pazos MM, Reznik, FJ, Vélez DE, Savino EA, Marina Prendes MG, Varela A. Differential effects of AMP-activated protein kinase in isolated rat atria subjected to simulated ischemia-reperfusion depending on the energetic substrates available. Pflugers Archiv – European Journal of Physiology. 2018, 470(2):367-383. DOI: 10.1007/s00424-017-2075-y. ISSN: 0031-6768
Hermann R, Vélez DE, Rusiecki TM, Fernández Pazos MM, Mestre Cordero VE, Marina Prendes MG, Savino EA, Varela A. Effects of 3-methyladenine on isolated left atria subjected to simulated ischaemia-reperfusion. Clinical and Experimental Pharmacology and Physiology. 2015, 42: 41-51. DOI: 10.1111/1440-1681.12323.ISSN 0305-1870.
Romina Hermann. “Papel de la quinasa activada por AMP en la injuria por isquemia-reperfusión bajo distintas condiciones metabólicas”. Tesis doctoral realizada bajo la dirección de la doctora Alicia Varela, con la dirección adjunta de la doctora María Gabriela Marina Prendes, en la Facultad de Farmacia y Bioquímica. Fue defendida el 6 de octubre de 2017 y obtuvo el mérito de Summa cum laude.








