Si te preguntasen cuál es el órgano más extenso del cuerpo humano, responsable del intercambio de agua y, en parte, de la regulación térmica, ¿qué dirías? Probablemente, “la piel”, contestando de manera correcta a la pregunta. Si bien la piel nos protege de la entrada de patógenos externos, al funcionar como una barrera física ante ellos, también deja pasar muchas sustancias beneficiosas para el organismo, como agua y nutrientes. De la misma manera, en todas y cada una de las células de nuestro cuerpo funciona una estructura que las envuelve, denominada membrana plasmática, que actúa como barrera selectiva, una especie de filtro que permite el pasaje de algunas cosas y no de otras.
La membrana plasmática está formada principalmente por un tipo especial de moléculas que repelen el agua, al igual que ocurre con las gotas que forma el aceite al mezclarlo con agua. Este tipo de moléculas, en este caso fosfolípidos y colesterol, forman una barrera que separa el interior del exterior de las células. Esa barrera especial no está formada solamente por lípidos. Recordemos que la célula necesita intercambiar materia con el exterior (así como ocurría con nuestra piel), por eso existen unas moléculas que pueden ser consideradas protagonistas principales de esos procesos de intercambio: las proteínas de membrana. Estas moléculas se encuentran insertas en las membranas y, la mayoría de ellas la atraviesan de lado a lado, conectando el adentro y el afuera de la célula.
¿Y por qué son las protagonistas? Bueno, fundamentalmente porque asisten la entrada y salida de todo tipo de moléculas, funcionando como un túnel. Hacen que algunas moléculas salgan más rápido de la célula, porque son tóxicas, por ejemplo. Y, viceversa, permiten que otras entren rápido, ya que si así no lo hicieran… ¡la célula podría morir de inanición! De ahí que se las considere la puerta de ingreso y egreso a la célula.
Dada la importancia de este tipo de proteínas, muchos laboratorios en el mundo las estudian, así como analizan la relación con su entorno, los lípidos presentes en la membrana. En particular, en el laboratorio dirigido por el doctor Juan Pablo Rossi, que depende de la Facultad de Farmacia y Bioquímica y del CONICET, la doctora María Florencia Pignataro estudió el efecto que ejercen los lípidos sobre una proteína de la membrana plasmática. Esta proteína se encarga de sacar Ca2+ de la célula en situaciones especiales donde la cantidad del ion empieza a ser problemática.
La protagonista principal del trabajo
Esta proteína, a la que llamamos PMCA (por las siglas en inglés de Plasma Membrane Calcium Pump), pertenece a un grupo de proteínas que utilizan la energía almacenada en el ATP (trifosfato de adenosina), para transportar iones de un lado al otro de las membranas celulares.
Ahora bien, imaginá la situación de un recital repleto, estás en la puerta, llegaste tarde y querés ingresar hasta ubicarte delante del escenario, ¿sería igual la energía que gastarías para intentar entrar en ese momento que la que invertirías si hubiera pocas personas adentro? Claramente, sería mucho más sencillo ingresar al recital cuando aún no hay tantos espectadores, ¿no? Bueno, a la célula le ocurre algo similar cuando necesita sacar al exterior moléculas de las cuales hay poca cantidad en su interior y mucho en el exterior, como ocurre con el ion Ca2+.
Para sacar moléculas con estas características existen proteínas de membrana que, en lugar de túneles, ahora deben funcionar como verdaderas ¨bombas¨ de moléculas y deberán usar energía para hacer que esas moléculas atraviesen la membrana y se queden en el exterior celular, al igual que en la situación del recital repleto. Estas bombas, entre ellas la PMCA, pueden funcionar como “cañones” que expulsan moléculas hacia el exterior celular. Ahora bien, ¿cómo se acciona un cañón? Habría que usar un combustible que, en el caso de las células, es el ATP, una pequeña molécula energética por excelencia en el metabolismo de los seres humanos. El ATP se degrada, liberando energía, y esa energía puede ser utilizada por la bomba para cumplir su función.
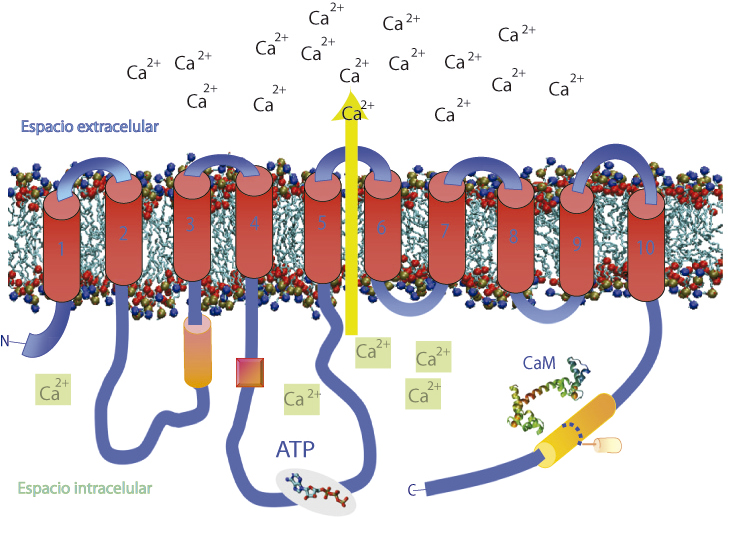
PMCA expulsando Ca2+ de la célula, en contra del gradiente. Una representación de la estructura de la bomba de calcio de la membrana plasmática inserta en una membrana compuesta por fosfolípidos. Se puede observar el sitio de unión de su principal modulador, la calmodulina (CaM) y la molécula de adenosina trifosfato (ATP), cuya ruptura aporta la energía necesaria para el transporte de calcio.
La función que realiza esta proteína es fundamental para cualquier célula, la concentración de Ca2+ intracelular está muy controlada ya que puede promover procesos como la contracción muscular, la secreción de hormonas y la comunicación entre neuronas. Sin embargo, un aumento descontrolado de la concentración podría ser fatal para la célula, ya que el Ca2+ puede promover apoptosis, que es la muerte celular programada de las células, algo así como un mecanismo de autodestrucción que ellas mismas accionan cuando se dan cuenta de que algo “no anda bien”.
A su vez, la actividad de la PMCA (es decir, la velocidad con que puede bombear o transportar calcio) se encuentra muy finamente regulada por otras moléculas que circulan por la célula en momentos específicos. Por ejemplo, la calmodulina, una pequeña proteína muy afín al Ca2+, se une a la PMCA cuando aumentan las concentraciones de Ca2+dentro de la célula y se necesita que rápidamente bajen, para evitar desencadenar los procesos que describimos previamente. Además, parte de la comunidad científica ha demostrado previamente que los fosfolípidos y ácidos grasos insaturados (denominados así ya que poseen dobles enlaces entre átomos de carbono), como el ácido oleico, también modulan positivamente la función de la PMCA, pero los mecanismos son prácticamente desconocidos.
Las proteínas de membranas no son islas
¿Qué son y para qué sirven los sistemas lipídicos artificiales?
Para estudiar el efecto que ejercen los lípidos sobre el funcionamiento de la PMCA se construyeron sistemas lipídicos artificiales. El estudio de la PMCA en el entorno celular natural sería muy complejo ya que existen distintos tipos de proteínas y azúcares, además de distintos tipos de lípidos. En cambio, la composición de estos sistemas artificiales es conocida y se la puede variar fácilmente. Estos sistemas están compuestos por distintos fosfolípidos que son los componentes principales de las membranas plasmáticas. Cuentan con una región hidrofóbica y otra hidrofílica, es decir que una parte de la molécula repele el agua y otra gusta de ella.
Además, en el sistema de estudio, se agrega otra molécula de características especiales, similar a un fosfolípido, pero más pequeña y móvil, un detergente. Es muy común que los científicos se valgan de sistemas artificiales sencillos, construidos en el laboratorio, para poder entender fenómenos complejos. Se los puede llamar modelos. Ahora bien, en la membrana plasmática real no existen moléculas de detergente, entonces ¿usarlo no invalidaría el modelo de estudio? Bueno, no lo hace porque otras investigaciones han demostrado previamente que la PMCA se comporta, funcionalmente, de modo similar en las estructuras artificiales y en la membrana plasmática natural.
Estos sistemas artificiales de lípidos y detergente se denominan micelas. Utilizamos una serie de micelas diferentes para rodear a la PMCA, variamos la proporción de detergente/fosfolípido y, a su vez, variamos diferentes largos de cadenas carbonadas de los fosfolípidos. Como podemos ver en el esquema (Adaptado de Jensen y Mourits, 2007), una proteína de membrana (representada por la caja roja y azul) se la rodea de fosfolípidos de distintos largos de cadena y se los “acomoda” de manera tal que se sienta más “cómoda” con su entorno.

Estos sistemas artificiales de lípidos y detergente se denominan micelas. Utilizamos una serie de micelas diferentes para rodear a la PMCA, variamos la proporción de detergente/fosfolípido y, a su vez, variamos diferentes largos de cadenas carbonadas de los fosfolípidos. Como podemos ver en el esquema, una proteína de membrana (representada por la caja roja y azul) se la rodea de fosfolípidos de distintos largos de cadena y se los “acomoda” de manera tal que se sienta más “cómoda” con su entorno.
Por otro lado, y dado que en la membrana plasmática también pueden encontrarse ácidos grasos libres, que actúan como moléculas señalizadoras, y además cambian las propiedades de la membrana, afectando a las proteínas que allí se ubican, se estudió la modulación de la PMCA por el ácido oleico, un ácido graso insaturado, esencial para el metabolismo de los humanos. Con este fin se desarrolló y sintetizó en el laboratorio una sonda fotoactivable. Esta sonda se activa cuando se la expone a luz UV, y se une de manera irreversible a grupos químicos de la proteína que se encuentren cercanos. Este tipo de moléculas son muy útiles para el estudio estructural y funcional de distintas biomoléculas. Serían comparables a una especie de “etiqueta” que se puede pegar a cualquier otra molécula de interés y que permite encontrar lo que uno busca.
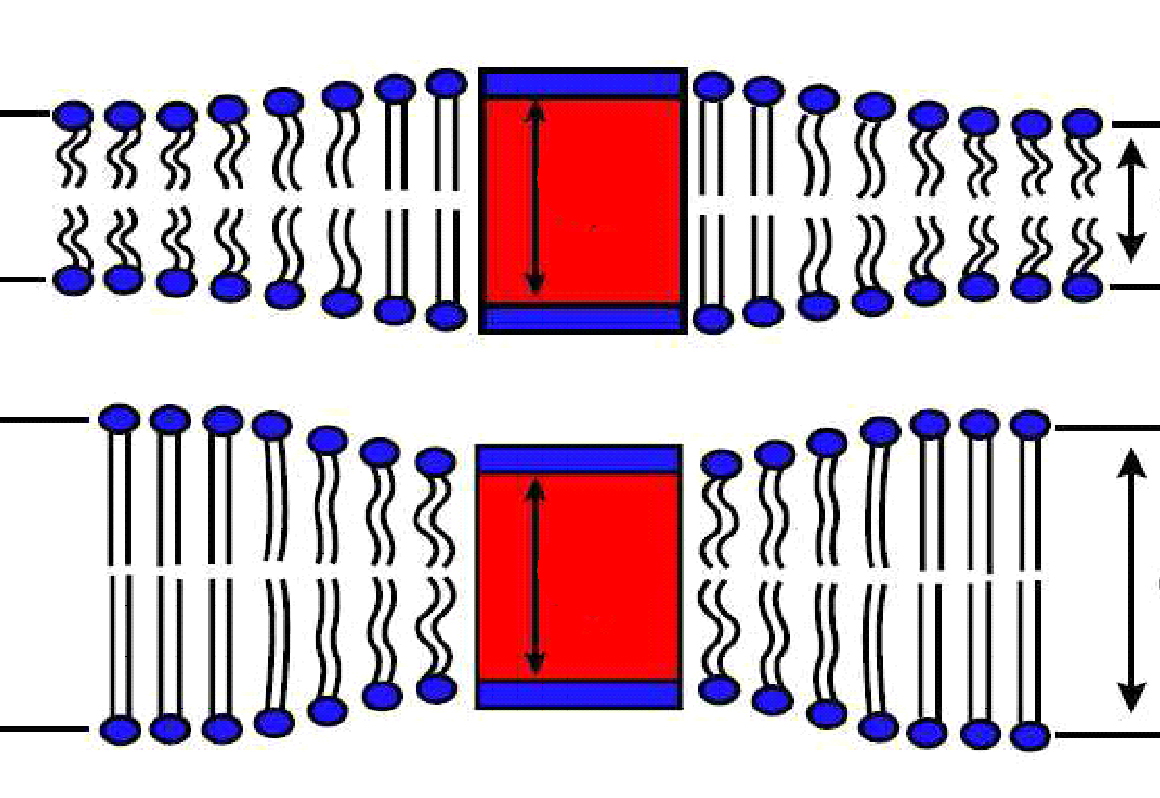
Adaptado de Jensen y Mourits, 2007
¿Qué descubrimientos novedosos aportó este trabajo?
Como ya se dijo, utilizamos una serie de micelas diferentes para rodear a la PMCA y determinar en cuál de estos entornos la proteína se hallaba más “cómoda”. En un principio, se determinó qué cantidad de moléculas de fosfolípido debería existir en la micela, con respecto a la cantidad de detergente y, además, qué fosfolípidos eran ideales para que la PMCA funcione de manera adecuada. Se encontró que la mayor actividad se encuentra en presencia de un fosfolípido de 14 átomos de carbono en su parte hidrofóbica y que aumenta a medida que se incrementa la proporción de fosfolípidos en la micela, hasta un punto crítico, en el que comienza a disminuir. Hasta el momento, no se conocían los mecanismos asociados a esta disminución de la actividad.
Por otro lado, el laboratorio tiene amplia experiencia en el estudio de las reacciones químicas que deben ocurrir para que se produzca el proceso de expulsión de Ca2+ a través de la PMCA desde el interior al exterior celular, utilizando la energía del ATP. Imaginá un gol de Lionel Messi. ¿Alguna vez viste su repetición en cámara lenta? Si bien el gol en tiempo real es rápido y casi no podés ver todos los movimientos que hizo para que la jugada termine en gol, cuando lo ves en cámara lenta apreciás todos y cada uno de los movimientos finos que llevaron a construir una jugada fantástica, digna de una destreza excepcional. De manera similar, mediante la utilización de una técnica que permite “tomar una foto” y “congelar” cada uno de los movimientos que hace la PMCA para transportar átomos de Ca2+, se determinó el tiempo que permanece en uno de esos movimientos cuando está en presencia de cada uno de los sistemas artificiales de lípidos, y esto permitió entender parte del mecanismo por el cual los lípidos afectan la actividad de la PMCA.
Mediante esta estrategia experimental se demostró que los fosfolípidos neutros modulan la actividad de la PMCA, modificando aspectos relacionados con la velocidad de bombeo de Ca2+ al exterior celular. Este resultado fue muy novedoso en el ámbito científico.
Además del diseño y la construcción de sistemas de lípidos artificiales para imitar a los naturales, presentes en la célula, la ciencia se vale de las computadoras para crear representaciones muy reales de estos mismos sistemas, pero que sólo existen en una realidad virtual. Pensá en un simulador de realidad virtual, allí uno puede ser parte de todo tipo de aventuras pero sin moverse de su asiento. De manera similar, el doctor Mauricio Sica, un colaborador del Centro Atómico Bariloche que se especializa en bioinformática, diseñó simulaciones computacionales que permitieron apreciar el funcionamiento y la interacción de modelos tridimensionales de la PMCA y los fosfolípidos que la rodean.
Al igual que en el simulador de aventuras, se debe ser muy exhaustivo en las características del entorno: se definen las coordenadas en el espacio de cada átomo y se definen la temperatura, la presión, entre otras. Se realizó un modelo de la PMCA, es decir que se construyó una gemela virtual de la proteína, que fue insertada en membranas de fosfolípidos (también virtuales) de distinto largo de cadena carbonada, de manera de explorar el efecto del largo del fosfolípido sobre la actividad biológica de la PMCA. Estos experimentos computacionales complementaron los experimentos realizados en el laboratorio y permitieron demostrar que el entorno lipídico más favorable para la PMCA es uno formado por fosfolípidos de cadena más corta, ya que la proteína logra acomodar mejor sus componentes hidrofílicos por fuera de un ambiente hidrofóbico, y así, funcionar más rápidamente en su tarea de expulsar Ca2+ al exterior celular.
Como dijimos, la actividad de transporte de Ca2+ de la PMCA aumenta ante la presencia de ácidos grasos libres en la membrana, entre ellos el ácido oleico. Para estudiar la modulación de la PMCA por ácidos grasos insaturados, se desarrolló un análogo fotoactivable de ácido oleico (que denominamos AS86). Esta sonda, fue sintetizada íntegramente en el laboratorio de la Facultad de Farmacia y Bioquímica durante el transcurso de este trabajo. Se demostró que se une de forma irreversible a la PMCA, es decir que queda como una “etiqueta”, fácilmente rastreable, en los sitios de la proteína donde se uniría originalmente el ácido oleico. Además, demostramos que, en presencia de la sonda, la proteína se comporta como si estuviese presente el ácido oleico en el entorno. Las evidencias demuestran la gran similitud entre la sonda fotoactivable AS86 y el ácido oleico, y la convierten así en una herramienta interesante para el estudio de otras biomoléculas que interaccionen con estos lípidos.
Conclusión y perspectivas
En conclusión, se ha estudiado la regulación del transporte de calcio de la PMCA por fosfolípidos neutros y por ácidos grasos insaturados mediante el desarrollo de diferentes estrategias experimentales. Además, hemos modelado computacionalmente la acción de estos lípidos sobre la estructura y la función de la PMCA. Este trabajo, realizado mayormente en la Facultad de Farmacia y Bioquímica, e íntegramente en nuestro país, constituye un avance en el entendimiento de los mecanismos que yacen detrás de la relación íntima entre lípidos y proteínas de membrana, y su continuación podría promover el desarrollo de nuevas estrategias para investigarlos. El estudio de la estructura proteica y su relación con la función resulta relevante no sólo para el diseño de nuevos fármacos sino para el conocimiento de los mecanismos fisiopatológicos de enfermedades que involucren a estas biomoléculas.

María Florencia Pignataro
Bioquímica, egresada de la Facultad de Farmacia y Bioquímica, UBA; se doctoró en Biofísica por la Universidad de Buenos Aires con la tesis “Influencia del entorno lipídico sobre la actividad biológica de la bomba de calcio de membrana plasmática”, bajo la dirección del doctor Juan Pablo Rossi y la dirección adjunta de la doctora Irene Mangialavori. La tesis mereció la calificación de Sobresaliente, 10, con mención summa cum laude.










Dejar un comentario